
Статью подготовили специалисты образовательного сервиса Zaochnik.
Уравнение состояния вещества
Содержание:
Параметры состояния связаны друг с другом. Соотношение, при котором определяется данная связь, называют уравнением состояния данного тела. В самом простом случае равновесное состояние тела определяется значением следующих параметров: давления , объема и температуры (масса тела или системы, как правило, известна).
Что такое идеальный газ
Уравнение состояния так называемого идеального газа является простым, но достаточно информативным.
Идеальный газ – это газ, в котором пренебрегают взаимодействием молекул между собой.
Идеальными считают разреженные газы. Особенно близки к идеальным газы гелий и водород. Идеальный газ – это упрощенная математическая модель реального газа: молекулы движутся хаотически, а соударения между молекулами и удары молекул о стенки сосуда упругие, не приводящие к потерям энергии в системе. Подобная упрощенная модель весьма удобна, поскольку не требует учета силы взаимодействия между молекулами газа. Множество реальных газов не отличаются в своем поведении от идеального газа в условиях, когда суммарный объем молекул пренебрежимо мал в сравнении с объемом сосуда (то есть при атмосферном давлении и комнатной температуре). Это дает возможность применять уравнение состояния идеального газа для сложных расчетов.
Уравнение состояния идеального газа запишем несколько раз :
.
Уравнение – уравнение Менделеева-Клапейрона, где – это масса газа, – это молярная масса газа, – это универсальная газовая постоянная, – это число молей вещества.
,
где – это количество молекул газа в массе , , постоянная Больцмана, определяющая «долю» газовой постоянной, которая приходится на молекулу и
,
– это постоянная Авогадро.
Если поделить в обе части на , то получаем следующий вид записи уравнения состояния идеального газа:
,
где – это количество частиц в единице объема или же концентрация частиц.
Что такое реальный газ
Рассмотрим теперь более сложные системы: неидеальные газы и жидкости.
Реальный газ – это газ, между молекулами которого наблюдаются заметные силы взаимодействия.
Необходимо учитывать, что в неидеальных, плотных газах взаимодействие молекул высоко. Известно, что взаимодействие молекул очень сильно усложняет физическую картину, потому точную формулу уравнения состояния неидеального газа не получается записать в простом виде. В данном случае прибегают к приближенным формулам, найденным полу-эмпирическим путем. Самая удачная формула – это уравнение Ван-деp-Ваальса.
Взаимодействие молекул обладает сложным характером. На достаточно больших расстояниях между молекулами действуют силы притяжения. С уменьшением расстояния силы притяжения вначале растут, однако потом уменьшаются и преобразуются в силы отталкивания. Притяжение и отталкивание молекул будем рассматривать и учитывать отдельно. Уравнение Ван-дер-Ваальса, которое описывает состояние одного моля реального газа, имеет вид:
,
где – это внутреннее давление, обусловленное силами притяжения между молекулами, – это поправка на собственный объем молекул, учитывающая действие сил отталкивания между молекулами, при этом:
,
где – это диаметр молекулы. Значение рассчитывается по формуле:
,
где – это потенциальная энергия притяжения -х молекул.
При увеличении объема значение поправок в уравнении становится менее существенным. И в пределе уравнение превращается в уравнение . Это согласовано с тем фактом, что с уменьшением плотности реальные газы по своим характеристикам приближаются к идеальным.
Положительным в уравнении Ван-деp-Ваальса является тот факт, что данное равенство при очень больших плотностях приблизительно описывает также и свойства жидкости, в частности, плохую ее сжимаемость. Потому существует основание предполагать, что уравнение Ван-деp-Ваальса позволяет отразить и переход от жидкости к газу (либо от газа к жидкости).
На рисунке представлена изотерма Ван-дер-Ваальса для некоторого постоянного значения температуры , которая построена из соответствующего уравнения.
В месте “извилины” (участок КМ) изотерма раза пересекает изобару. На участке
давление увеличивается с ростом объема.
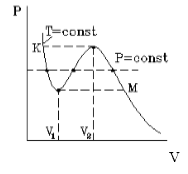
Рисунок
Подобная зависимость невозможна. Это означает, что в этой области с веществом происходит что-то необыкновенное. Что именно, не видно в уравнении Ван-деp-Ваальса. Обратимся к опыту. В месте “извилины” на изотерме в состоянии равновесия вещество расслаивается на фазы: жидкую и газообразную. Обе фазы существуют одновременно и находятся в фазовом равновесии. В таком состоянии происходит испарение жидкости и конденсация газа. Процессы протекают с такой интенсивностью, что полностью компенсируют друг друга: объем жидкости и газа со временем не изменяется.
Газ, который находится в фазовом равновесии со своей жидкостью, называется насыщенным паром. Если фазовое равновесие отсутствует, отсутствует также компенсация испарения и конденсации, тогда газ называется ненасыщенным паром.
Что происходит с изотермой в области двухфазного состояния вещества (то есть в месте "извилины" изотермы Ван-деp-Ваальса)? Эксперимент показывает, что в этом месте при изменении объема давление остается неизменным. График изотермы идет параллельно оси (рисунок ).
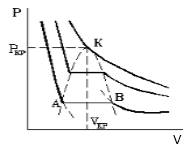
Рисунок
С увеличением температуры участок двухфазных состояний на изотермах уменьшается до тех пор, пока не превращается в точку (рисунок ). Это особая точка , в которой исчезает разница между жидкостью и паром. Ее называют критической точкой.
Параметры, которые соответствуют критическому состоянию, являются критическими (критическая температура, критическое давление, критическая плотность вещества).
Необходимо найти величину . В процессе, представленном на рисунке , давление .
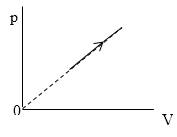
Рисунок
Решение
Из графика, приведенного на рисунке , запишем уравнение процесса в параметрах :
или .
С учетом уравнения Менделеева-Клайперона:
.
Подставив вместо объема, получаем:
Ответ: .
Моль кислорода охлаждают до . Необходимо определить давление, которое оказывает газ на стенки сосуда, если занимаемый газом объем . Необходимо также сравнить с давлением идеального газа , если бы кислород вел себя как идеальный газ. Величина постоянных Ван-дер-Ваальса и , для кислорода , .
Решение
Из уравнения Ван-Дер-Ваальса имеем:
Переведем температуру в систему измерения: , По условию .
Произведем расчет: .
Для идеального газа:
Рассчитаем: .
Ответ: .
Навигация по статьям
