
Статью подготовили специалисты образовательного сервиса Zaochnik.
Уравнение состояния идеального газа. Изопроцессы
Содержание:
Соотношение – это формула, связывающая значение давления газа с его температурой и концентрацией молекул на единицу объема.
Они взаимодействуют со стенками сосуда посредствам упругих соударений. Данное выражение можно записать иначе, учитывая параметрические состояния объема , давления , температуры и количества вещества . Применим неравенства:
.
Значением является количество молекул данного сосуда, – постоянной Авогадро, – массой газа в емкости, – молярной массой газа. Исходя из этого, формула примет вид:
.
Произведение постоянной Авогадро на постоянную Больцмана называют универсальной газовой постоянной и обозначают .
По системе имеет значение .
Соотношение получило название уравнения состояния идеального газа.
Один моль газа обозначается .
При температуре и давлении говорят о нормальных условиях состояния газа.
Из уравнения видно, что один моль газа при нормальных условиях занимает один и тот же объем, равный . Выражение получило название закона Авогадро.
Если имеется смесь невзаимодействующих газов, то формулу запишем как:
,
где обозначает количество вещества каждого из них.
Еще в ХХ веке Б. Клапейрон получил уравнение, показывающее связь между давлением и температурой:
.
Впоследствии оно было записано Д.И. Менделеевым. Позже его назвали уравнением Клапейрона-Менделеева.
Задолго до получения уравнения состояния идеального газа на основе молекулярно-кинетической теории поведения газов изучались в различных условиях экспериментально. То есть уравнение служит обобщением всех опытных фактов.
Газ принимает участие в процессах с постоянно изменяющимися параметрами состояния: (и ).
При протекании процессов медленно, система находится в состоянии, близком к равновесному. Процесс получил название квазистатического.
Соотнеся с происхождением процессов в нашем времени, то его протекания нельзя считать медленными.
Обычное время для разрежения и сжатия газа сотни раз в секунду. Это рассматривается как квазистатический процесс. Они изображаются с помощью диаграммы состояний параметров, где каждая из точек показывает равновесное состояние.
При неизменном одном параметре из ( или ) процесс принято называть изопроцессом.
Изотермический процесс
При протекании квазипроцесса с постоянным параметром говорят об изотермическом процессе.
Из уравнения имеем, что неизменные температура с количеством вещества – это постоянное состояние для произведения значения давления газа на его объем :
.
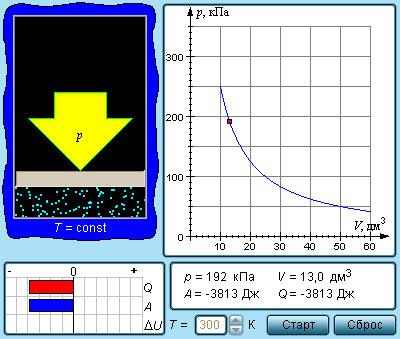
Рисунок Модель изотермического процесса.
Изображение изотермических процессов на плоскости предусматривает различные значения температур гипербол . Они получили название изотермов.
Коэффициент пропорциональности данного отношения увеличивается с ростом . Рисунок показывает, что при меньшей подразумевает уменьшение . В году было получено уравнение изотермического процесса Р. Бойлем, а позднее Э. Мариоттом в году. Отсюда и сложное его название – закон Бойля-Мариотта.
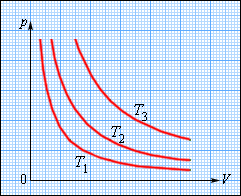
Рисунок Семейство изотерм на плоскости . .
Изохорный процесс
Изохорный процесс – это квазипроцесс нагревания или охлаждения газа с постоянным параметром и неизменным количеством вещества емкости.
Уравнение состояния идеального газа говорит о том, что изменение p газа происходит прямо пропорционально абсолютной температуры, тогда или .
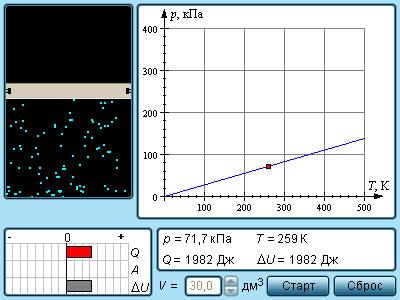
Рисунок Модель изохорного процесса.
Изохорные процессы плоскости с количеством вещества и различными значениями параметра изображаются прямыми линиями – изохорами.
Рисунок говорит о наличии меньшего наклона оси при увеличении параметра .
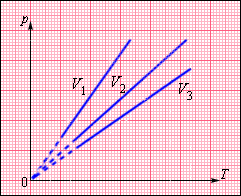
Рисунок Семейство изохор на плоскости . .
Экспериментальную зависимость параметра от довелось исследовать физику Ж. Шарлю в году. Позже уравнения изохорного процесса получило название закона Шарля.
Его запись принимает вид
с ,
являющимся значением давления газа при (т.е. при температуре ). Температурный коэффициент давления обозначается .
Изобарный процесс
Изобарный процесс – это квазистатический процесс, протекающий с постоянным параметром .
Уравнение такого состояния с неизменным количеством вещества запишется как
или , где - объем газа при температуре . Температурный коэффициент объемного расширения газов равняется .
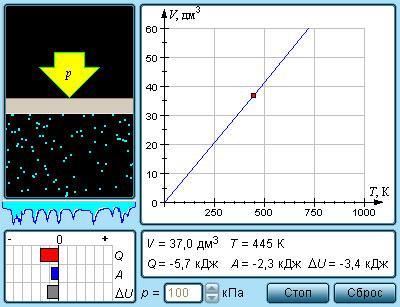
Рисунок Модель изобарного процесса.
Изобарные процессы плоскости имеют разные значения и изображены прямыми линиями (изобарами), изображенными на рисунке
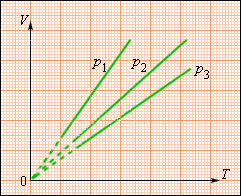
Рисунок Семейство изобар на плоскости . .
Данное уравнение с зависимостью параметра от с неизменным давлением довелось исследовать Ж. Гей-Люссаку в году. Оно получило название закона Гей-Люссака.
Законы Бойла-Мариотта, Шарля и Гей-Люссака объясняются с помощью молекулярно-кинетической теории газов, так как являются следствиями уравнения состояния идеального газа.
Навигация по статьям
